时间:2021-09-26 来源:美国威力塔斯学校 关注度:2533
这些看似简单的生活常识,解释起来却并非易事,因为微观状态的化学反应,看不见,摸不着,学生们难以理解。在我的化学课堂上,我喜欢拿台球运动模拟化学反应,生动又形象。
台球,是大家日常生活中熟悉的休闲娱乐项目,将球击打进洞需要两个充分条件:1 瞄准方向;2 给予足够的力量。一旦碰撞成功,目标球进洞即可得分。与之类似,化学反应是由微观粒子碰撞,一旦粒子碰撞时的方向正确,力度足够,反应就发生了!看似完全不相关的两件事,在化学课上却完全统一。
然而,看似简单的碰撞问题在AP化学考试中频繁出现,下面是2018年官方样题中一道选择题,考察学生对于“瞄准方向”的理解。

从反应方程式上看,NO的N会从NO3中夺走一个O, 所以,NO的N与NO3中的O碰撞才是有效的,进而生成产物NO2。所以,D是正确选项。
充分条件之二“力度”,我喜欢称之为“及格线”,化学专业术语是“活化能”。凡是能越过“及格线”的粒子,才有资格发生有效碰撞生成产物。
众所周知,催化剂能加快反应,让粒子间的有效碰撞大幅增加,其实是因为催化剂降低了反应必需的“及格线”,让更多的粒子越过“及格线”碰撞成功。
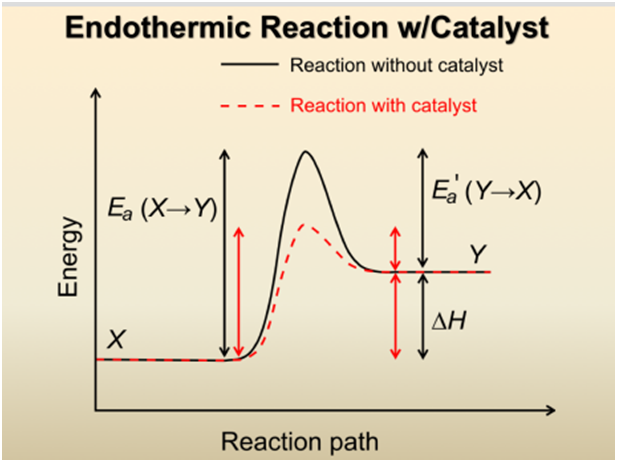
如图所示,峰高即为“及格线”(活化能),加入催化剂后峰值降低,更多反应物可越过峰值变成产物。
由此看来,即使是高大上的生命科学(化学)也可以用通俗易懂的方式娓娓道来...